Перейти к:
Сравнительная характеристика ранозаживляющего эффекта ксерогеля на основе нейтрального гидрозоля диоксида титана для терапии ожоговых ран
https://doi.org/10.17709/2409-2231-2021-8-1-3
Аннотация
Цель исследования. Оценить морфофункциональное состояние раневого дефекта при использовании ксерогеля на основе нейтрального гидрозоля диоксида титана, в сравнении с аргосульфаном.
Материалы и методы. После моделирования у 40 самцов крыс аутбредного стока Вистар раневого дефекта на кожном покрове межлопаточной области рана закрывалась повязкой. Животные были разделены на 4 группы: 1 – контрольная группа (10 крыс), в которой никакие препараты на поверхность ожога не наносили; 2 – группа препарата сравнения (10 самцов, которым после моделирования ожога на поверхность раны ежедневно наносился препарат сравнения аргосульфан); 3 – экспериментальная группа № 1 (10 самцов, которым после моделирования на поверхность раны ежедневно наносился ксерогель в дозе 0,1 мл/100г массы тела животного); 4 – экспериментальная группа № 2 (10 самцов, которым после моделирования патологии на поверхность раны ежедневно наносился ксерогель в дозе 0,2 мл/100г массы тела животного на протяжении трех недель после моделирования ожога).
Результаты. Комплекс морфофункциональных изменений в экспериментальных группах включал в себя изменения в эпидермисе – восстановление более полноценного эпидермального слоя, более выраженное в экспериментальной группе № 2. Вероятно, это обеспечивается не только непосредственной стимуляцией пролиферации клеток базального и шиповатого слоев, но и иными механизмами, на что указывает ядерно‑цитоплазматическое соотношение. В соединительно‑тканной основе раневого эффекта экспериментальных групп отмечалось формирование визуально более разветвлённой сети сосудов гемомикроциркуляторного русла и снижение признаков венозной гиперемии.
Заключение. Таким образом, эффективной дозой ксерогеля является 2 мл/кг. Выявленный комплекс локальных морфофункциональных перестроек в тонкой коже позволяет считать ксерогель перспективным средством для применения при заболеваниях и состояниях, характеризующихся нарушением целостности кожного покрова, в том числе и при ожоговом поражении.
Для цитирования:
Дуданов И.П., Виноградов В.В., Криштоп В.В., Никонорова В.Г. Сравнительная характеристика ранозаживляющего эффекта ксерогеля на основе нейтрального гидрозоля диоксида титана для терапии ожоговых ран. Research'n Practical Medicine Journal. 2021;8(1):30-39. https://doi.org/10.17709/2409-2231-2021-8-1-3
For citation:
Dudanov I.P., Vinogradov V.V., Сhrishtop V.V., Nikonorova V.G. Comparative characteristics of the well-healing xerogel effect based on the neutral hydrozol of titanium dioxide for burner therapy. Research and Practical Medicine Journal. 2021;8(1):30-39. (In Russ.) https://doi.org/10.17709/2409-2231-2021-8-1-3
ВВЕДЕНИЕ
В 2017 году в мире было зарегистрировано около 8 991 468 новых случаев термической травмы, из которых 120 632 случаев закончились летально [1]. В 2018 году по данным Федеральной службы государственной статистики (Росстат) количество пострадавших от ожогов составило 241,0 случай на 100 000 человек населения [2], что составило более 350 тысяч случаев. При этом пациенты нуждаются в основном в консервативном лечении, которое в 70% случаев можно провести в условиях амбулаторных учреждений. Примечательно, что 60–80% обожженных, которых госпитализируют на стационарное лечение, тоже имеют поверхностные и пограничные ожоги [3]. В связи с этим особую актуальность приобретает разработка новых лекарственных средств для терапии ожогов. Перспективным средством может стать ксерогель, в отличие от гидрогеля, классически используемого для противоожоговой терапии, который состоит из сшитых полимеров, из которых удалена жидкая среда. Благодаря этому у этого класса гелей уменьшается пористость, давление внутри геля, вязкость. Поверхностное натяжение в ксерогеле также исчезает, а коэффициент диффузии при этом имеет очень высокое значение. Благодаря этому ксерогели представляют большой интерес для местного применения при дефектах кожных покровов [4]. Например, биомиметический ксерогель кремнезема, благодаря своей мезопористой структуре, обеспечивает высокую системную стабильность и клеточный трансмембранный транспорт для лекарственных средств [5]. При формировании мультимодального ксерогелевого композита хитозан-желатин, наполненного наночастицами диоксида кремния и кальция, может использоваться для остановки кровотечений [6].
Цель исследования: оценить морфофункциональное состояние раневого дефекта при использовании ксерогеля на основе нейтрального гидрозоля диоксида титана, в сравнении с аргосульфаном.
МАТЕРИАЛЫ И МЕТОДЫ
Синтез ксерогеля на основе нейтрального гидрозоля диоксида титана был осуществлен в лаборатории SCAMT Университета ИTMO (SCAMT laboratory – Solution Chemistry of Advanced Materials and Technologies, Лаборатория растворной химии передовых материалов и технологий). Эксперименты проводились на 40 крысах – самцах аутбредного стока Вистар, массой 200–220 г. В каждой экспериментальной группе было 10 самцов. За трое суток до моделирования ожоговой травмы в области спины крысам проводили выбривание участков кожи машинкой для стрижки животных. Термические ожоги вызывали путем наложения медной монеты на 10 сек на кожу межлопаточной области спины волосяного покрова, нагретой до 200oС, площадь соприкосновения 380 мм2.
Через сутки на месте ожогов возникали раны в виде изъязвлений, заполненных некротическими массами, что соответствует III Б степени ожога. Все манипуляции выполнялись под временной внутримышечной анестезией золетилом [7].
Животные были разделены на 4 группы: 1 – контрольная группа, включала в себя 10 самцов. Контрольной группе животных никакие препараты на поверхность ожога не наносили; 2 – группа препарата сравнения, включала в себя 10 самцов, которым после моделирования патологии с лечебной целью на поверхность раны ежедневно наносился препарат сравнения аргосульфан; 3 – экспериментальная группа № 1, включала в себя 10 самцов, которым после моделирования патологии ежедневно с лечебной целью на поверхность раны ежедневно наносился ксерогель, в дозе 0,1 мл/100 г массы тела животного; 4 – экспериментальная группа № 2, включала в себя 10 самцов, которым после моделирования патологии ежедневно с лечебной целью на поверхность раны наносился ксерогель, в дозе 0,2 мл/100 г массы тела животного.
Через 21 сутки после моделирования животные выводились из эксперимента передозировкой золетила, после чего производилось гистологическое исследование кожных покровов в области регенерации, иссеченных с участком краев раны. Были использованы следующие гистологические окраски: гематоксилин и эозин, трихромная окраска по Пикро Малори – для выявления структур соединительной ткани, толлуидиновый синий – для выявления тканевых базофилов, а также метиленовый зеленый и пиронин (Окраска по Браше).
Гистологические микропрепараты оценивались визуально (цифровая камера Levenhuk C1400 NG, программа Levenhuk ToupView). Также на микропрепаратах регенерата лабораторных крыс при помощи программы ImageJ 1. 45s проводилось морфометрическое исследование ряда параметров. Толщину клеточного слоя эпидермиса (до рогового слоя) оценивали путем 3‑х измерений в 1 поле зрения при объективе х40, проводимых перпендикулярно к базальной мембране. От каждого животного из группы исследовали по одному срезу. Для определения средних геометрических размеров кератиноцита шиповатого слоя исследовали по одному срезу от каждого животного из группы. Измерения производили при окуляре х40. В поле зрения измеряли площади кератиноцитов и их ядер, площадь цитоплазмы определялась как разность между площадью кератиноцита и площадью его ядра. Число измерений в группе составляло 100 и более. Ядерно-цитоплазматическое отношение рассчитывали по формуле (1):
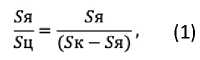
где Sк – площадь клетки;
Sц – площадь цитоплазмы клетки;
Sя – площадь ядра кератиноцита.
Для определения площади ядрышка кератиноцита шиповатого слоя исследовали по одному срезу от каждого животного из группы. Измерения производили при иммерсионном увеличении окуляр х90, на микропрепаратах, окрашенных по метиленовым зеленым – пиронином. Число измерений в группе составляло 100 и более.
Оценивали удельную долю сосудов микроциркуляторного русла в субэпидермальном участке соединительно-тканного рубца на уровне сосочкового слоя дермы. Для этого от каждого животного из группы исследователи брали по одному срезу, окрашенному гематоксилином и эозином. Измерения производили во всех полях зрения, где присутствовали сосуды, при окуляре х10. Проводили измерение суммарной площади сосудов микроциркуляторного русла субэпидермального участка рубца, после этого измеряли общую площадь дермы в поле зрения. Расчет вели по формуле (2):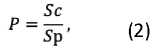
где Р – удельная доля сосудов (%);
Sc – суммарная площадь сосудов в поле зрения;
Sр – площадь соединительно-тканного рубца на
уровне сосочкового слоя дермы в поле зрения.
Все манипуляции с использованием животных проводились в соответствии с этическими принципами, установленными Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и других научных целей (принятой в Страсбурге 18.03.1986 г. и подтвержденной в Страсбурге 15.06.2006 г.).
Статистическую обработку результатов проводили при помощи компьютерной программы «Statistica 6,0». Рассчитывали среднее, стандартное отклонение (М±m) и дисперсию. Сравнение двух независимых групп проводили с использованием U критерия Манна-Уитни. Уровень статистической значимости p≤0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
На микропрепаратах участка раны, окрашенных гематоксилином и эозином, обращает на себя внимание низкий уровень репаративных процессов в контрольной группе. Многослойный плоский эпителий в центре раневого деффекта – тонкий, толщина шиповатого слоя составляет около 3 слоев кератиноцитов. Клетки мелкие. Ядра компактные (рис. 1A). Рельеф базальной мембраны сглажен. В группе сравнения толщина эпителиального пласта значительно возрастает, что достоверно подтверждается данными статистического исследования (табл. 1). Базальная мембрана становится извилистой (рис. 1B). Толщина шиповатого слоя возрастает. В кератиноцитах зернистого слоя отчетливо визуализируются гранулы. Клетки становятся крупными, ядра увеличиваются в размерах, приобретают округлую форму, во многих клетках визуализируется ядрышко. Выявленные изменения также характерны и для клеток базального слоя эпидермиса.
Таблица 1. Морфометрические показатели области раневого дефекта
Table 1. Morphometric indicators for the wound defect area
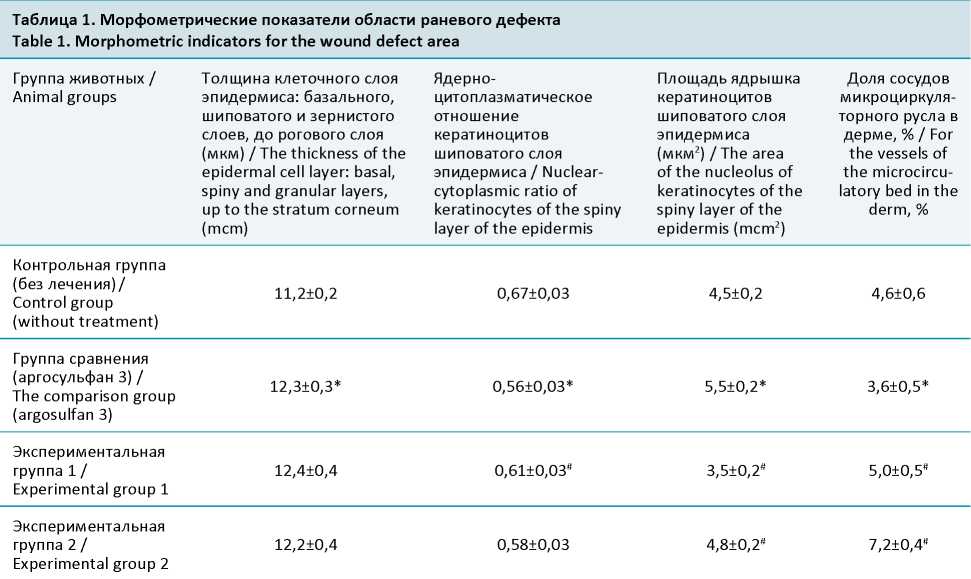
Примечание: * – различия с контрольной группой достоверны (p<0,05); #– различия с группой сравнения достоверны (p<0,05)
Note: * – differences with the control group are significant (p<0.05); #– differences with the comparison group are significant (p<0.05)
Для экспериментальных групп характерны еще более глубокие базальные разрастания новообразованного эпидермиса, характеризующиеся в экспериментальной группе № 2, (рис. 1C, 1D). Известно, что кератиноциты базального слоя разделяются на 2 типа – с гладкой и зубчатой поверхностями. Кератиноциты с гладкой поверхностью представлены стволовыми клетками, их количество составляло около 10% от общего числа клеток этого слоя [8]. Для обеих экспериментальных групп также характерны признаки активации восстановительных процессов в эпителии раневого дефекта. Однако, выраженность морфологических критериев репаративных процессов в эпидермисе экспериментальных групп не превышает аналогичную в группе сравнения. Это подтверждается более высокими показателями ядерно-цитоплазматического отношения (0,54±0,03 в группе сравнения и 0,59±0,02 в экспериментальной группе № 1, 0,56±0,03 в экспериментальной группе № 2) (табл. 1). Известно, что последнее является показателем уровня дифференцировки кератиноцита: если ядерно-цитоплазматическое отношение равно или больше 1, то клетку относят к стволовым, юным или напротив, умирающим клеткам, а если меньше 1, то это характерно для зрелых, дифференцированных, активно функционирующих клеток. При этом, чем меньше значение ядерно-цитоплазматического отношения, тем выше степень дифференцировки клетки [9]. Таким образом, клетки шиповатого слоя группы сравнения характеризуются наивысшим уровнем дифференцировки, за ними идут кератиноциты экспериментальной группы № 2, № 1 и уже потом контрольной группы.
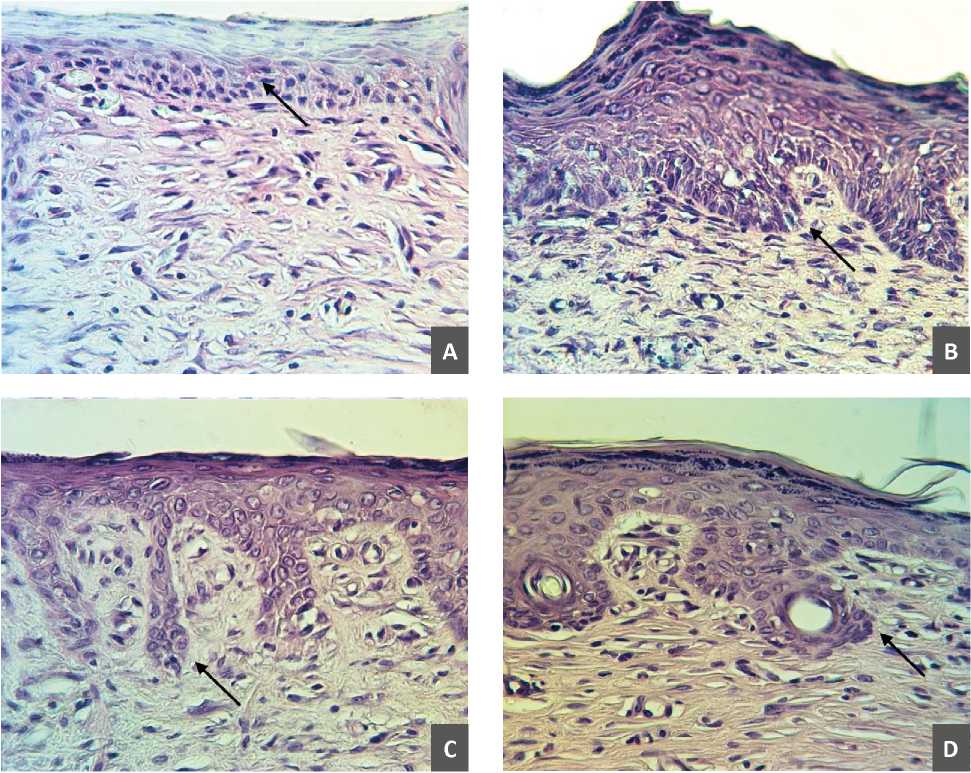
Рис. 1. Состояние эпидермиса в зоне регенерата. Окраска гематоксилин и эозин, ув. х400.
Обозначения: А) Контрольная группа (без лечения); B) Группа сравнения (препарат сравнения аргосульфан 3); C) Экспериментальная группа 1, получавшая представленный образец лекарственного средства, действующего на Толл-подобные рецепторы 4 и 6, в дозе 0,1 мл/100 г массы тела животного; D) Экспериментальная группа 2, получавшая представленный образец лекарственного средства, действующего на Толл-подобные рецепторы 4 и 6, в дозе 0,2 мл/100 г массы тела животного.
Fig. 1. State of the epidermis in the regenerate zone. Coloration of hematoxylin and eosin, increase x 400.
Indications: A) Control group (without treatment); B) Comparison group (preparation for comparison of argosulfan 3); C) Experimental group 1, which received the presented sample of the medicine acting on Toll-like receptors 4 and 6 in dose 0,1 ml/100 g of animal body weight; D) Experimental group 2, which received the presented sample of the medicine acting on Toll-like receptors 4 and 6 in dose 0,2 ml/100 g of animal weight.
Эта тенденция подтверждается и при статистическом исследовании микропрепаратов, окрашенных по Браше, на которых измеряли площадь ядрышка, которая может служить показателем активности процессов внутриядерной транскрипции (табл. 1): наибольшая площадь ядра в группе сравнения, затем в экспериментальной группе № 2, № 1, и, самая низкая, в контрольной группе. Вместе с тем стоит отметить состояние эпидермиса в зоне регенерата,– более интенсивную окраску пиронином цитоплазмы клеток придатков кожи, которые активно формируются в экспериментальной группе № 2 (рис. 2D) в отличие от контрольной группы (без лечения) (рис. 2А), группы сравнения (препарат сравнения аргосульфан (рис. 2B) и экспериментальной группы 1 (рис. 2C). На сегодняшний день идентифицированы три различных вида ниши эпидермальных стволовых клеток: выпуклость наружного эпителиального влагалища волосяного фолликула HF, основание сальной железы и базальный слой волосяной воронки IFE. При естественном обновлении корнеоцитов источником новых базальных клеток является последняя ниша [10]. Однако, при заживлении ран участвуют все варианты ниш [11][12][13]. Именно поэтому так важно полноценное восстановление придатков кожи, наблюдаемое нами в экспериментальных группах.
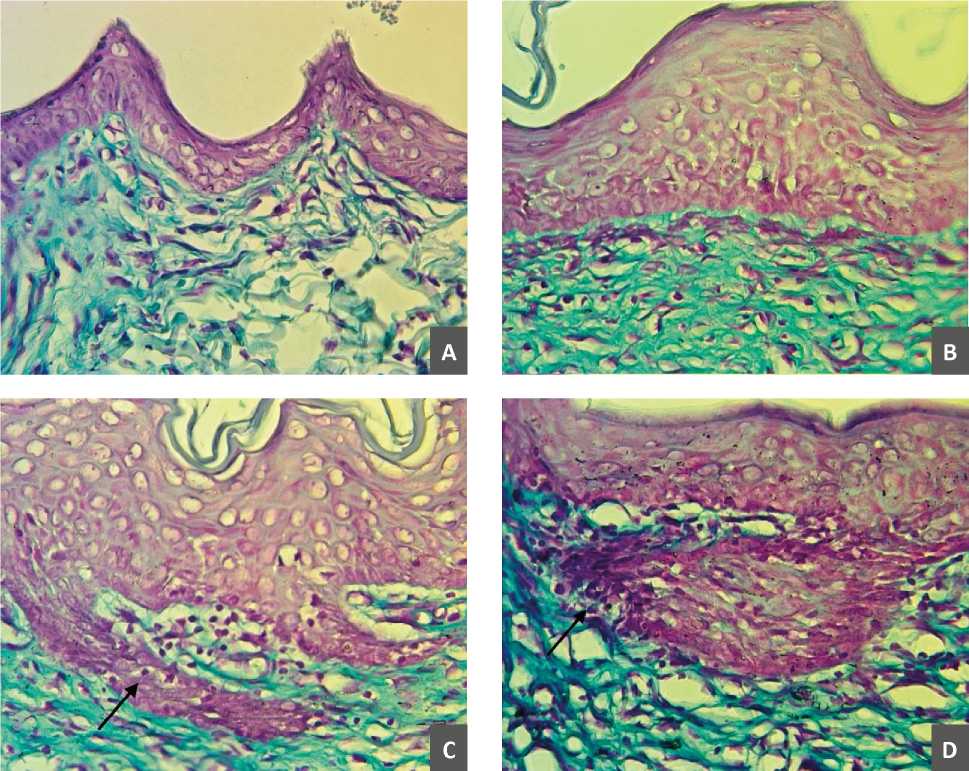
Рис. 2. Состояние эпидермиса в зоне регенерата. Окраска методом Браше, ув. х400.
Обозначения: А) Контрольная группа (без лечения); B) Группа сравнения (препарат сравнения аргосульфан 3); C) Экспериментальная группа 1; D) Экспериментальная группа 2.
Fig. 2. State of the epidermis in the regenerate zone. Painting method Brashe, x400.
Markings: A) Control group (without treatment); B) Comparison group (preparation of comparison of argosulfan 3); C) Experimental group 1; D) Experimental group 2.
Замещающий собой раневой дефект регенерат представляет собой плотную волокнистую неоформленную соединительную ткань, в которую проникают элементы гемомикроциркуляторного русла. Сосуды последнего более многочисленны в области дна раны, на уровне гиподермы, а также под эпителием в области поверхностного сплетения кожи. В этой области они, как правило, располагаются параллельно базальной мембране эпидермиса (рис. 3). В контрольный группе эти сосуды характеризуются наличием морфологических признаков венозной гиперемии: расширенными просветами вен, заполненных эритроцитами в состоянии сладжа, а также артериолами с пустым просветом (рис. 3А). Для группы сравнения (рис. 3В) характерно значительное уменьшение количества субэпидермальных сосудов гемомикроциркуляторного русла. Однако, в экспериментальных группах их количество возрастает (риc. 3С), в большей степени в экспериментальной группе № 2 (рис. 3D), при этом признаков венозной гиперемии не отмечается.
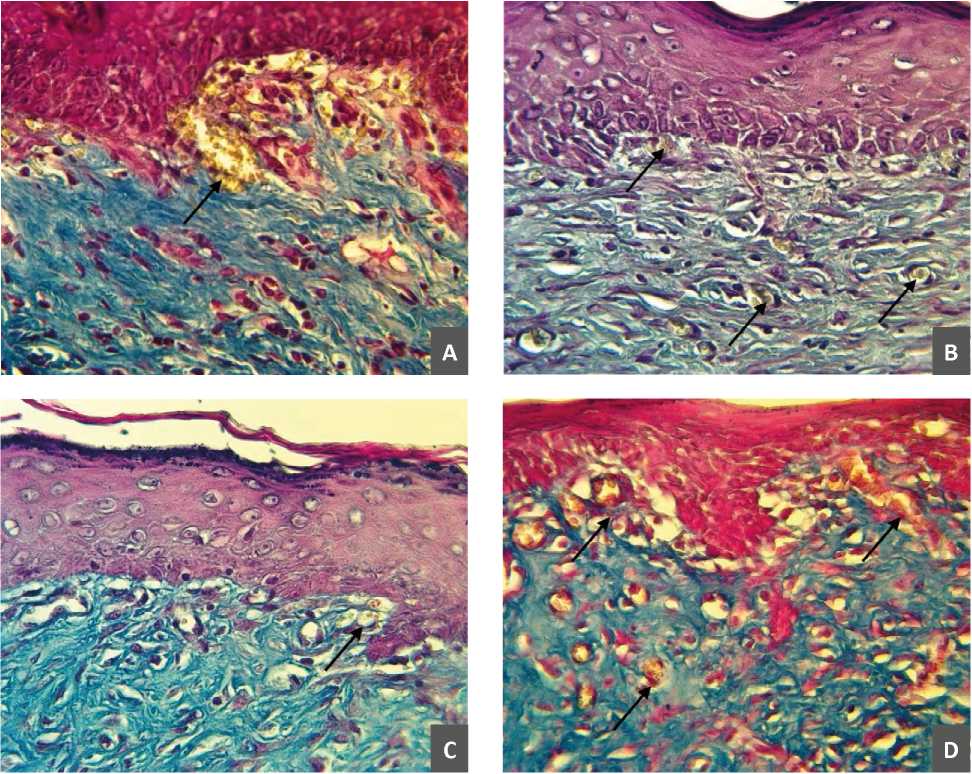
Рис. 3. Состояние субэпидермальных сосудов гемомикроциркуляторного русла в зоне регенерата. Окраска Пикро-Малори, ув. х400.
Обозначения: А) Контрольная группа (без лечения); B) Группа сравнения (препарат сравнения аргосульфан 3); C) Экспериментальная группа 1, получавшая представленный образец лекарственного средства, действующего на Толл-подобные рецепторы 4 и 6 в дозе 0,1 мл/100 г массы тела животного; D) Экспериментальная группа 2, получившая представленный образец лекарственного средства, действующего на Толл-подобные рецепторы 4 и 6 в дозе 0,2 мл/100 г массы тела животного.
Fig. 3. Condition of subepidermal vessels of the hemomicrocirculatory channel in the regenerate zone. Piccro-Malory, x400.
A) Control group (without treatment); B) Comparison group (Argosulfan 3); C) Experimental group 1, which received a presented sample of the drug acting on Toll-like receptors 4 and 6 in a dose of 0.1 ml/100 g of animal body weight; D) Experimental group 2, which received a presented sample of the drug acting on Toll-like receptors 4 and 6 in a dose of 0.2 ml/100 g of animal weight.
Следует отметить, что если в контрольной группе и группе сравнения ход сосудов в регенерате, как правило, однонаправленный, о чем свидетельствуют преимущественно поперечные срезы сосудов, то в экспериментальных группах отмечаются как поперечные так и продольные срезы сосудов, что указывает на более полноценную, разветвлённую сеть гемомикроциркуляции [14].
Аналогичные изменения характерны и для сосудов в толще соединительной ткани регенерата. В контрольной группе они выглядят пережатыми соединительно-тканными волокнами, полнокровными, с пристеночной адгезией эритроцитов их выстраиванием в виде «монетных столбиков». В группе сравнения количество сосудов снижается на 22% по сравнению с показателями контрольной группы. В экспериментальной группе их количество возрастает, однако ни спазма артериол, ни пристеночной адгезии эритроцитов, ни иных морфологических эквивалентов нарушенной гемомикроциркуляции отмечено не было. Визуальная оценка подтверждается данными статистического исследования (табл. 1). Самая большая удельная доля сосудов гемомикроциркуляторного русла характерна для экспериментальной группы № 2, за ней следуют экспериментальная группа № 1, контрольная группа и группа сравнения.
Таким образом, полученные нами данные отражают не только стадийность раневого процесса, т.е. клиническое течение местных изменений (воспаление, развитие некроза и его ограничение, рубцевание и эпителизация раны), но и указывают на сокращение сроков протекания вышеуказанных процессов. Комплекс морфофункциональных изменений в экспериментальных группах включает в себя изменения в эпидермисе – восстановление более полноценного эпидермального слоя. Вероятно, это обеспечивается не только непосредственной стимуляцией пролиферации клеток базального и шиповатого слоев, но и иными механизмами, такими как эффекты мезопористой поверхности, формируемой ксерогелем [15], на что указывает ядерно-цитоплазматическое соотношение. В соединительно-тканной основе раневого эффекта экспериментальных групп отмечается формирование более разветвлённой сети сосудов гемомикроциркуляторного русла и снижение признаков венозной гиперемии, что способствует лучшей оксигенации тканей ожогового дефекта. Очевидно, что значимую роль в вышеописанных эффектах, может играть отсутствие водного компонента в ксерогеле [16]. Все вышеописанные процессы более выражены в экспериментальной группе № 2, чем № 1.
Работы, описывющие использования ксерогелей для ускорения ранозаживления, малочисленны. Нами продемонстрирована способность ксерогеля, синтезированного с помощью «имитационной» щелочной химии на основе липоевой кислоты, к захвату более 60% бактерий Staphylococcus aureus за счет сильной электростатической адсорбции в колониях с числом бактерий 106. Кроме того, этот ксерогель может адгезироваться к кожным покровам, что позволяет использовать его в виде пластырей при лечении ран [17]. In vitro продемонстрирована эффективность сшитого ионами стронция альгинат-gполи (ПЭГМА) ксерогеля для заживления ран [18]. Исследования проведены на клетках фибробластов L929 и кератиноцитах HaCaT. Активность заживления ран in vitro анализировали с помощью анализа царапин на ранах в клетках HaCaT. Для изучения влияния на синтез коллагена использовали клетки L929. Показано, что материал способствует синтезу коллагена фибробластами, более быстрому закрытию раневого дефекта, и низкой цитотоксичности. Также авторы указывают на необходимость исследований in vivo для оценки и дальнейшего изучения потенциала заживления ран. In vivo ксерогель β-циклодекстрина, содержащий фиброин шелка, продемонстрировал высокую эффективность заживления ран при пролежнях, образовавшихся на спине мыши линии ICR [19]. Это сопровождалось снижением гиперплазии эпидермиса кожи. Авторы предполагают, что снижение образования рубцов связано с адсорбцией структурой ксерогеля эккрета, благодаря чему обеспечивается эффект заживления в водной среде. Исследования ранозаживляющих эффектов ксерогеля, а в основе оксида титана ранее не проводились.
ЗАКЛЮЧЕНИЕ
Эффективной дозой ксерогеля является 2 мл/кг. Выявленный комплекс локальных морфофункциональных перестроек позволяет считать ксерогель на основе нейтрального гидрозоля диоксида титана перспективным средством для применения при заболеваниях и состояниях, характеризующихся нарушением целостности кожного покрова, в том числе и при ожоговом поражении.
Список литературы
1. James SL, Lucchesi LR, Bisignano C, Castle CD, Dingels ZV, Fox JT, et al. Epidemiology of injuries from fire, heat and hot substances: global, regional and national morbidity and mortality estimates from the Global Burden of Disease 2017 study. Inj Prev. 2020 Oct;26(Supp 1):i36–i45. https://doi.org/10.1136/injuryprev-2019-043299
2. Здравоохранение в России 2019. Статистический сборник. Росстат. М.;З-46; 2019, 170 с. Доступно по: https://rosstat.gov.ru/storage/mediabank/Zdravoohran-2019.pdf
3. Van Lieshout EM, Van Yperen DT, Van Baar ME, Polinder S, Boersma D, Cardon AY, et al. Epidemiology of injuries, treatment (costs) and outcome in burn patients admitted to a hospital with or without dedicated burn centre (Burn-Pro): protocol for a multicentre prospective observational study. BMJ Open. 2018 Nov 15;8(11):e023709. https://doi.org/10.1136/bmjopen-2018-023709
4. Pramanik R, Ganivada B, Ram F, Shanmuganathan K, Arockiarajan A. Influence of nanocellulose on mechanics and morphology of polyvinyl alcohol xerogels. J Mech Behav Biomed Mater. 2019 Feb;90:275–283. https://doi.org/10.1016/j.jmbbm.2018.10.024
5. Jiang Q, Wu L, Zheng Y, Xia X, Zhang P, Lu T, et al. Biomimetic micellar mesoporous silica xerogel performs superior nitrendipine dissolution, systemic stability and cellular transmembrane transport. Mater Sci Eng C Mater Biol Appl. 2021 Jan;118:111372. https://doi.org/10.1016/j.msec.2020.111372
6. Patil G, Torris A, Suresha PR, Jadhav S, Badiger MV, Ghormade V. Design and synthesis of a new topical agent for halting blood loss rapidly: A multimodal chitosan-gelatin xerogel composite loaded with silica nanoparticles and calcium. Colloids Surf B Biointerfaces. 2020 Nov 6;111454. https://doi.org/10.1016/j.colsurfb.2020.111454
7. Привольнев В.В., Пасхалова Ю.С., Родин А.В. Местное лечение ран и раневой инфекции по результатам анонимного анкетирования хирургов России. Клиническая микробиология и антимикробная химиотерапия. 2016;18(2):152–158. 8. Tani H, Morris RJ, Kaur P. Enrichment for murine keratinocyte stem cells based on cell surface phenotype. Proc Natl Acad Sci U S A. 2000 Sep 26;97(20):10960–10965. https://doi.org/10.1073/pnas.97.20.10960
8. Свирщевская Е.В., Матушевская Е.В. Роль липидов в барьерных свойствах кожи. Клиническая дерматология и венерология. 2019;18(3):360–365.
9. Watt FM, Lo Celso C, Silva-Vargas V. Epidermal stem cells: an update. Curr Opin Genet Dev. 2006 Oct;16(5):518–524. https://doi.org/10.1016/j.gde.2006.08.006
10. Ito M, Cotsarelis G. Is the hair follicle necessary for normal wound healing? J Invest Dermatol. 2008 May;128(5):1059–1061. https://doi.org/10.1038/jid.2008.86
11. Langton AK, Herrick SE, Headon DJ. An extended epidermal response heals cutaneous wounds in the absence of a hair follicle stem cell contribution. J Invest Dermatol. 2008 May;128(5):1311–1318. https://doi.org/10.1038/sj.jid.5701178
12. Lau K, Paus R, Tiede S, Day P, Bayat A. Exploring the role of stem cells in cutaneous wound healing. Exp Dermatol. 2009 Nov;18(11):921–933. https://doi.org/10.1111/j.1600-0625.2009.00942.x
13. Криштоп В.В., Пахрова О.А., Стрельников А.И. Основы системной гемореологии. Иваново, 2015, 128 с.
14. Iglin VA, Sokolovskaya OA, Morozova SM, Kuchur OA, Nikonorova VG, Sharsheeva A, et al. Effect of Sol-Gel Alumina Biocomposite on the Viability and Morphology of Dermal Human Fibroblast Cells. ACS Biomater Sci Eng. 2020 Aug 10;6(8):4397–400. https://doi.org/10.1021/acsbiomaterials.0c00721
15. Стрельников А.И., Томилова И.К., Сафронов Б.Г., Криштоп В.В., Алексахина Е.Л., Шпаковский Д.Б. и др. Сравнительная характеристика in vivo действия водорастворимой и липофильной форм дипиколиламина, содержащего фрагмент 2,6-ди- трет-бутилфенола, на окислительный статус тканей крыс. Известия Академии наук. Серия химическая. 2014;(5):1238.
16. Huang B, Liu X, Tan L, Cui Z, Yang X, Jing D, et al. “Imitative” click chemistry to form a sticking xerogel for the portable therapy of bacteria-infected wounds. Biomater Sci. 2019 Dec 1;7(12):5383–5387. https://doi.org/10.1039/c9bm01417a
17. Gp R, Mr R. Strontium ion cross-linked alginate-g-poly (PEGMA) xerogels for wound healing applications: in vitro studies. Carbohydr Polym. 2021 Jan 1;251:117119. https://doi.org/10.1016/j.carbpol.2020.117119
18. Seo SR, Lee MS, So BP, Kim J-C. In vivo pressure sore-healing efficacy of β-cyclodextrin/polyethyleneimine/silk fibroin xerogel. Int J Dermatol. 2012 Aug;51(8):987–995. https://doi.org/10.1111/j.1365-4632.2011.05389.x
Об авторах
И. П. ДудановРоссия
Дуданов Иван Петрович – чл.-корр. РАН, д.м.н., профессор, заведующий кафедрой общей и факультетской хирургии; консультант
SPIN: 7617-9535, AuthorID: 107304
185910, г. Петрозаводск, пр. Ленина, д. 33
197101, г. Санкт-Петербург, Кронверкский просп., д. 49
В. В. Виноградов
Россия
Виноградов Василий Валентинович – аспирант кафедры общей и факультетской хирургии
SPIN: 7965-2524, AuthorID: 1019640
185910, г. Петрозаводск, пр. Ленина, д. 33
197101, г. Санкт-Петербург, Кронверкский просп., д. 49
В. В. Криштоп
Россия
Криштоп Владимир Владимирович – к.м.н.
SPIN: 3734-5479, AuthorID: 110744,
Scopus AuthorID: 57207690596, ResearcherID: J-3456-2017
197101, г. Санкт-Петербург, Кронверкский просп., д. 49
В. Г. Никонорова
Россия
Никонорова Варвара Геннадьевна – младший научный сотрудник
SPIN: 2161-4838, AuthorID: 1009877,
Scopus AuthorID: 57217099371, ResearcherID: AAI-7758-2020
153012, г. Иваново, ул. Советская, д. 45
Рецензия
Для цитирования:
Дуданов И.П., Виноградов В.В., Криштоп В.В., Никонорова В.Г. Сравнительная характеристика ранозаживляющего эффекта ксерогеля на основе нейтрального гидрозоля диоксида титана для терапии ожоговых ран. Research'n Practical Medicine Journal. 2021;8(1):30-39. https://doi.org/10.17709/2409-2231-2021-8-1-3
For citation:
Dudanov I.P., Vinogradov V.V., Сhrishtop V.V., Nikonorova V.G. Comparative characteristics of the well-healing xerogel effect based on the neutral hydrozol of titanium dioxide for burner therapy. Research and Practical Medicine Journal. 2021;8(1):30-39. (In Russ.) https://doi.org/10.17709/2409-2231-2021-8-1-3
JATS XML


























