Перейти к:
Причины неудовлетворительных результатов после лапароскопических пластик грыж пищеводного отверстия диафрагмы
https://doi.org/10.17709/2409-2231-2021-8-1-4
Аннотация
Цель исследования. Анализ причин неудовлетворительных результатов после пластики грыж пищеводного отверстия диафрагмы, осложненных гастроэзофагеальной рефлюксной болезнью.
Материалы и методы. В исследовании проведен ретроспективный анализ результатов лечения 171 пациента, оперированных лапароскопически по поводу грыж пищеводного отверстия диафрагмы за период 2009–2018 годов. При размерах грыжевого дефекта 5 и более сантимтров 29 пациентам (29,6%) из 98 применена аллопластика. Фундопликация по Ниссену применена у 109 (63,7%) пациентов, по Тупе – у 62 пациентов (36,3%). Интраоперационно оценена протяженность интраабдоминального сегмента пищевода после медиастинальной мобилизации, а также после десуфляции перед формированием фундопликационной манжетки. Проведено изучение протяженности фундопликационной манжетки у пациентов, не имевших жалоб в отдаленном послеоперационном периоде. Проведен анализ причин повторных оперативных вмешательств.
Результаты. В отдаленном периоде рецидив отмечен у 34 пациентов (19,9%), стойкая длительная дисфагия у 10 пациентов (5,8%), в целом неудовлетворительный результат составил 22,8% (39 пациентов). Неудовлетворены своим состоянием были 26 (15,2%) пациентов (по шкале‑опроснику GERD – HRQL). На частоту рецидива в отдаленном периоде при пластике грыж 5 и более см не оказало влияния применение аллопластики в сравнении с простой шовной крурорафией – 4 (13,8%) против 14 (20,3%), ДИ: 0,19–2,1, p=0,44. Так же, на частоту рецидива не оказал влияния выбор способа фундопликации при использовании методик Ниссена и Тупе, частота рецидива составила 17,4% (19/109) против 24,2% (15/62), ДИ: 0,71–3,24, p=0,39. Протяженность фундопликационной манжетки при рентгенконтрастном исследовании составила 3,2 см (2,3–3,7 см). Интраоперационно после десуфляции укорочение пищевода составило 1,3 см (0,5–2 см). Повторно оперированы 12 пациентов (7%). Во всех случаях повторных оперативных вмешательств выявлено укорочение пищевода.
Заключение. Одним из возможных факторов, влияющим на частоту развития рецидива в отдаленном периоде, является нередуцированный интраоперационно короткий пищевод, который диагностирован во время выполнения всех повторных оперативных вмешательств. Необходимо проведение дальнейших исследований, оценивающих применение процедур по удлинению пищевода на отдаленные результаты лечения.
Ключевые слова
Для цитирования:
Гринцов А.Г., Ищенко Р.В., Совпель И.В., Совпель О.В., Балабан В.В. Причины неудовлетворительных результатов после лапароскопических пластик грыж пищеводного отверстия диафрагмы. Research'n Practical Medicine Journal. 2021;8(1):40-52. https://doi.org/10.17709/2409-2231-2021-8-1-4
For citation:
Grintcov A.G., Ishchenko R.V., Sovpel I.V., Sovpel O.V., Balaban V.V. Causes of unsatisfactory results after laparoscopic hiatal hernia repair. Research and Practical Medicine Journal. 2021;8(1):40-52. (In Russ.) https://doi.org/10.17709/2409-2231-2021-8-1-4
АКТУАЛЬНОСТЬ
Грыжа пищеводного отверстия диафрагмы (ГПОД) – заболевание, характеризующееся смещением через пищеводное отверстие диафрагмы в грудную полость абдоминального отдела пищевода, кардии, верхнего отдела желудка, а иногда и петель кишечника. Длительное существование ГПОД приводит к нарушению анатомо-функциональных взаимоотношений в зоне кардиоэзофагеального перехода, что рано или поздно приводит к появлению клинических симптомов. Наиболее частым осложнением данного заболевания является развитие гастроэзофагеальной рефлюксной болезни. Появление болевого синдрома, хронических язв и эрозий в зоне кардиоэзофагеального перехода либо экстрапищеводных проявлений иногда в значительной степени ухудшает качество жизни пациента и требует, иногда многократно, обращаться к врачу за медицинской помощью [1][2][3][4].
Хирургическое вмешательство, выполненное лапароскопически, является основным методом коррекции данного состояния, постепенно вытесняет другие методики лечения. На сегодняшний день накоплен достаточно большой опыт данных хирургических вмешательств. Одной из основных проблем после выполнения пластики ГПОД является высокая частота неудовлетворительных результатов и рецидивов, которые в отдаленном периоде выявляются в среднем в 15–25% [2][3][5][6][7], а по данным некоторых авторов достигают 50–60% [8][9].
В отдельных случаях, при развитии послеоперационных осложнений и рецидивов в отдаленном периоде, качество жизни пациента может быть хуже в сравнении с дооперационным периодом [3][10]. Огромное разнообразие методик и способов оперативного вмешательства, направленных на улучшение результатов лечения, не привело к выработке единого унифицированного подхода хирургическому лечению пациентов с данной патологией.
Цель исследования: анализ результатов хирургического лечения больных грыжей пищеводного отверстия диафрагмы, осложненной гастроэзофагеальной рефлюксной болезнью, и выявление возможных причин неудовлетворительных результатов лечения в отдаленном периоде.
МАТЕРИАЛЫ И МЕТОДЫ
В настоящем исследовании проведен ретроспективный анализ результатов хирургического лечения 171 пациента за период 2009–2017 гг., оперированных по поводу грыж пищеводного отверстия диафрагмы, осложненных гастоэзофагеальной рефлюксной болезнью, на клинических базах Донецкого государственного медицинского университета им. М.Горького. Все пациенты оперированы в объеме лапароскопической крурорафии и фундопликации.
Показаниями к оперативному лечению данной группы пациентов были:
- клинически, рентгенологически и эндоскопически подтвержденные ГПОД;
- длительно существующий гастроэзофагеальный рефлюкс, а также клинически значимые экстрапищеводные проявления ГПОД и ГЭРБ на фоне неэффективной консервативной терапии 3 и более месяцев;
- возраст пациентов старше 18 лет, отсутствие тяжелой сопутствующей патологии, анестезиологический риск по шкале ASA не выше 3.
Все случаи ГПОД были подтверждены полипозиционным рентгенконтрастным исследованием пищевода и желудка и при фиброгастродуоденоскопии. Обязательными обследованиями на дооперационном этапе также были общеклинические, биохимические анализы крови и мочи, УЗИ органов брюшной полости, рентгенография легких. С целью подтверждения патологического желудочного рефлюкса пациентам выполнялась рН-метрия пищевода. В сомнительных случаях для подтверждения наличия ГПОД рентгенконтрастное и эндоскопическое исследования дополнялись компьютерной томографией.
Оперативные вмешательства выполнялись лапароскопически и включали следующие обязательные стандартные этапы: рассечение пищеводно-диафрагмальной связки с иссечением грыжевого мешка с сохранением ветвей блуждающего нерва; препарирование обеих ножек диафрагмы, трансхиатальная мобилизация пищевода в средостении для достижения длинны его интраабдоминального сегмента 2–3 см; мобилизация дна желудка путем пересечения желудочно-селезеночной связки с проходящими в ней короткими желудочными артериями для создания манжетки без натяжения; редуцирование дефекта пищеводного отверстия диафрагмы; создание фундопликационной манжетки на желудочном зонде 30–36Fr [1][3][5].
При размерах дефекта пищеводного отверстия диафрагмы 5 и более см применялись две общепринятых методики. У 69 пациентов (70,4%) применена пластика грыжевого дефекта шовным способом. У 29 пациентов (29,6%) применена пластика аллотрансплантатом. В группе шовной крурорафии в зависимости от величины пищеводного отверстия диафрагмы производилась задняя крурорафия с использованием от 2 до 4 узловых нерассасывающихся швов «Ethibond» 2–0, при необходимости задняя крурорафия дополнялась одним переднелатеральным швом. В группе крурорафии с аллопластикой ножки диафрагмы во время сшивания укреплялись со стороны брюшной полости сетчатым трансплантатом, который располагался V-образно. В крурорафии с аллопластикой использованы 2 типа сетчатых трансплантатов: нерассасывающийся трансплантат Prolene (Ethicon) – у 12 пациентов (41,4%) и композитный частично-рассасывающийся трансплантат Ultrapro (Ethicon) – у 17 пациентов (58,6%). В анализируемой группе пациентов применены 2 наиболее распространенных способа фундопликации: у 109
пациентов (63,7%) применена фундопликация по Ниссену, у 62 пациентов (36,3%) применена фундопликация по Тупе. Активизация пациента начиналась через 6–8 часов в постели, питье разрешалось через 12 часов, питание перетертой пищей через 36–48 часов после операции.
Длинна интраабдоминального сегмента пищевода оценена у 28 пациентов (16,4%). При ее определении локализация гастроэзофагеального перехода четко выявлялась при помощи интраоперационной эзофагогастроскопии, расстояние между Z-линией и пищеводным отверстием диафрагмы фиксировалось в сантиметрах.
Контрольные осмотры проводились через 3, 6 и 12 месяцев после операции, затем ежегодно в течение 5 лет, либо при необходимости внепланово. Отдаленные результаты хирургического лечения пациентов, страдающих ГПОД, оценены в сроки от 1 года до 7 лет, в среднем период наблюдения за пациентами составил 50±8,7 месяцев. Обязательным методом обследования при ежегодном контрольном осмотре после операции являлось рентгенконтрастное исследование пищевода и желудка, которое в случае наличия жалоб либо 1 раз в 2–3 года дополнялось эндоскопическим исследованием. При необходимости, для пациентов, имевших рецидив жалоб ГЭРБ, не подтвержденный рентгенологически или эндоскопически, проводился суточный внутрипищеводный рН-мониторинг с расчетом индекса DeMeester. При подозрении на рецидив всем пациентам выполнялась компьютерная томография. Субъективные методы включали изучение соматического статуса при помощи специализированного опросника GERD-HRQL (GERD-Health Related Qualityof Life Questionnaire), являющегося наиболее специфичным при оценке результатов хирургического лечения ГПОД и ГЭРБ [2].
Сразу стоить отметить, что единой общепринятой классификации неудовлетворительных результатов после пластик ГПОД не существует [3][5]. Под неудовлетворительным результатом мы понимали любое патологическое состояние после выполненного оперативного вмешательства, диагностированное клинически либо при помощи дополнительных методов обследования и которое может быть как клинически значимым, так и бессимптомным. В своей практике мы предлагаем и придерживаемся следующего варианта классификации данных состояний. При оценке отдаленных результатов мы считаем целесообразным подразделять неудовлетворительные результаты на 2 группы: рецидив и стойкая длительная дисфагия. Рецидивы мы разделяли на 2 подгруппы. Анатомические рецидивы – случаи, при которых в послеоперационном периоде рецидив подтвержден рентгенологически либо эндоскопически. Под анатомическим рецидивом, диагностированным рентгенологически, мы, как и ряд других авторов, понимали пролабирование кардиоэзофагеальной мембраны в средостение более 2 см. Анатомический рецидив объединяет любое патологическое отклонение в зоне ранее выполненной операции, к которым относят как истинный рецидив ГПОД в виде расхождения ранее сшитых ножек диафрагмы и формирование нового грыжевого мешка, так и разрушение и миграцию манжетки в средостение, либо ее соскальзывание на кардиальный отдел желудка. Функциональные рецидивы – случаи, при которых клинически имеется появление жалоб, имевшихся до операции и связанных с ГЭРБ, но без подтвержденных рентгенологически признаков анатомического в зоне ранее выполненного оперативного вмешательства, и обусловленные, вероятно, недостаточной функцией сформированной антирефлюксной манжетки. Изолированная, сохраняющаяся более 3‑х месяцев либо появившаяся в сроки позднее 3‑х месяцев после выполненного оперативного вмешательства, без диагностированного анатомического рецидива дисфагия нами выделена в отдельную группу. К данному виду осложнения не относится дисфагия функционального характера, которая отмечается в первые 2–3 месяца после оперативного вмешательства и обусловлена реакцией и адаптацией пациента к сформированной фундопликационной манжетке.
Статистический анализ был проведен в программе RStudio Version 1.2.1335© 2009–2019 RStudio, Inc., GPL. Количественные переменные представлены в виде среднего и стандартного отклонения, т.к. все они имели нормальное распределение (тест Шапиро–Уилка). При сравнении двух независимых групп с количественными переменными был использован T-критерий Стьюдента. Номинальные и порядковые переменные представлены в виде процентов. Для сравнения номинальных шкал применялся критерий Пирсона, если не более 20% ожидаемых частот было меньше 5, в противном случае применялся точный критерий Фишера.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Через 1 год рецидивы отмечены у 14 пациентов (8,2%). Среди них у 10 пациентов (5,8%) имел место анатомический рецидив, подтвержденный рентгенологически. У 4 пациентов (2,3%) наблюдался рецидив ГЭРБ без подтвержденного рентгенологически анатомического рецидива.
Через 5 лет после оперативного вмешательства рецидивы отмечены у 32 пациентов (18,7%). Функциональные рецидивы, проявившиеся появлением клиники ГЭРБ выявлены у 14 пациентов (8,2%), анатомический рецидив диагностирован у 18 пациентов (10,5%).
Стойкая длительная дисфагия при приеме плотной пищи в позднем послеоперационном периоде отмечена у 10 пациентов (5,8%). Однако стоит отметить, что у 5 пациентов (5,8%) с наблюдаемой стойкой длительной дисфагией в последующем был диагностирован анатомический рецидив ГПОД.
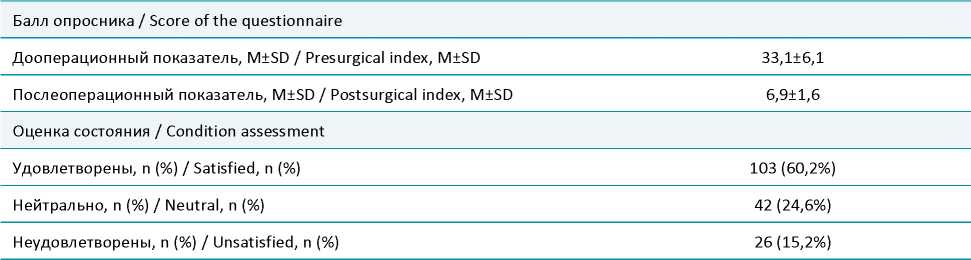
При изучении функциональных результатов хирургического лечения пациентов (табл. 2), страдающих ГПОД были получены следующие результаты. Суммарный балл по шкале-опроснику GERD – HRQL через 5 лет после операции составил 6,9±1,6 в сравнении с исходным дооперационным показателем 33,1±6,1. Через 5 лет после оперативного лечения 103 пациента (60,2%) были удовлетворены своим состоянием, нейтрально результаты оперативного вмешательства оценили 42 пациента (24,6%), неудовлетворены были 26 пациентов (15,2%).
Таблица 1. Отдаленные результаты пластики грыж пищеводного отверстия диафрагмы
Table 1. Long-term results of hernia repair of the esophageal orifice of the diaphragm
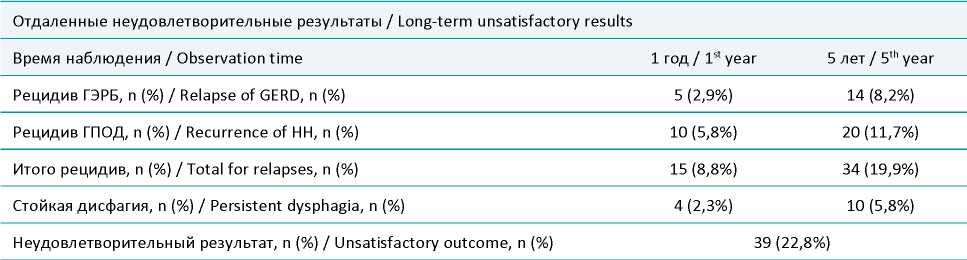
Таблица 2. Функциональные результаты хирургического лечения пациентов с ГПОД через 5 лет при помощи анкетыопросника GERD-HRQL
Table 2. Functional results of surgical treatment of patients with HH after 5 years of using the GERD-HRQL questionnaire
Таким образом неудовлетворительный результат в целом отмечен у 39 пациентов (22,8%). Полученный высокий процент неудовлетворительных результатов потребовал проведения более глубокого анализа пациентов данной группы. Проведена оценка влияния различных технических приемов, используемых при выполнении оперативного вмешательства. Так, в зависимости от способа формируемой фундопликационной манжетки пациенты разделены на 2 группы: фундопликация по Ниссену (109 пациентов) и фундопликация по Тупе (62 пациента). Сравнительный анализ результатов применения различных антирефлюксных приемов показал их одинаковую эффективность в ближайшем и отдаленном периоде. Выбор способа фундопликации не повлиял на длительность оперативного вмешательства, частоту интра- и послеоперационных осложнений, удельный вес функциональной дисфагии – 24 (22%) против 8 (12,9%), p=0,14 количество неудовлетворительных результатов, в частности, рецидива – 19 (17,4%) против 15 (24,2%), ДИ: 0,71–3,24, p=0,39, и стойкой длительной дисфагии 8 (7,3%) против 2 (3,2%), ДИ: 0,5–10,38; р=0,27.
В зависимости от способа пластики пищеводного отверстия диафрагмы пациенты с размерами грыжевого отверстия диафрагмы 5 и более см разделены на 2 группы сравнения: 69 пациентам выполнена пластика грыжевого дефекта обычным шовным способом, и 29 пациентам выполнена пластика грыжи ГПОД сетчатым аллотрансплантатом. Анализ
отдаленных результатов через 5 лет после проведенного исследования показал отсутствие преимущества использования сетчатого трансплантата при пластике больших ГПОД в сравнении со стандартной шовной пластикой как по частоте рецидивов – 4 (13,8%) против 14 (20,3%), ДИ: 0,19–2,1, p=0,44,– так и при оценке качества жизни по опроснику GERDHRQL. Более того, в группе аллопластики была отмечена отчетливая тенденция к увеличению частоты стойкой длительной дисфагии – 4 случая (13,8%) в сравнении с шовным способом – 2 случая (2,9%), p=0,053. Из тяжелых осложнений, ассоциированных с имплантацией сетки, можно отметить, что у 1 пациентки, оперированной в 2013 году, в случае которой была применена аллопластика проленовым сетчатым нерассасывающимся трансплантатом, в 2019 году была выявлена аррозия сетчатого импланта в пищевод, что потребовало выполнения повторного оперативного вмешательства, которое потребовало конверсии и выполнения проксимальной резекции желудка и нижней трети пищевода. Так же, 1 пациент через 2 года был повторно оперирован по поводу нарастающей дисфагии. После диагностической лапароскопии в выполнении дальнейшего оперативного вмешательства пациенту отказано в виду выраженного неразделимого рубцово-спаечного процесса в зоне ранее выполненного оперативного вмешательства и установленного сетчатого импланта. Полученные результаты, несмотря на имеющиеся в литературе сведения, послужили основанием отказаться от рутинного применения метода аллопластики при лапароскопической коррекции ГПОД.
Всем пациентам, находившимся под наблюдением, вне зависимости от наличия жалоб выполнялось рентгенконтрастное исследование. Анализ рентгенархива показал, что у пациентов, не имевших клинических проявлений рецидива ГПОД, в большинстве случаев удается получить хорошие снимки, на которых можно увидеть расправленную воздухом и контрастным веществом сформированную фундопликационную манжетку (рис. 1). При этом, протяженность фундопликационной манжетки при полипозиционном рентгенконтрастном исследовании составила 3,2 см (2,3–3,7 см). Так же было отмечено, что у пациентов, имевших клинические проявления рецидива либо дисфагии, не удалось визуализировать фундопликационную манжетку на рентгенограммах. Пациентам, не имевшим симптомов рецидива ГПОД и которым не удавалось получить информативные рентгенограммы, дополнительно проводилась фиброгастроскопия, компьютерная томография и внутрипищеводная рН-метрия. Именно так части пациентов удавалось заподозрить и диагностировать бессимптомные рецидивы ГПОД.
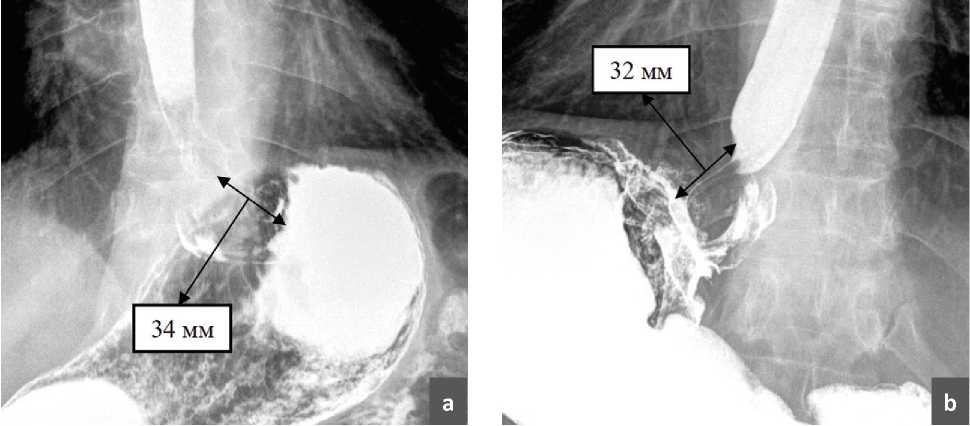
Рис. 1. Протяженность фундопликационной манжетки при рентгенконтрастном исследовании: a – 34 мм; b – 32 мм.
Fig. 1. The length of the fundoplication cuff during an X-ray contrast examination: a – 34 mm; b – 32 mm.
Однако при оценке качества жизни из 39 пациентов только 26 (66,7%) были не удовлетворены результатом выполненной им операции. Из 26 пациентов от предложенного повторного оперативного вмешательства отказались 14 пациентов. Повторные операции нами выполнены 12 пациентам (7,0%). 2 пациентам (1,2%) повторные оперативные вмешательства выполнены по поводу тяжелой дисфагии, причем в обоих случаях ранее была применена аллопластика; характер операций описан выше. В связи с подтвержденным анатомическим рецидивом повторно оперированы 6 пациентов (3,5%), в связи с функциональным рецидивом – 4 пациента (2,3%). Интраоперационно у пациентов с анатомическим рецидивом миграция манжетки в средостение была выявлена у 4 пациентов (2,3%), соскальзывание манжетки на кардиальный отдел желудка у 2 пациентов (1,2%). У пациентов, имевших функциональный рецидив перед оперативным вмешательством, была выявлена незначительная недиагностированная миграция манжетки в сторону средостения с вклиниванием в пищеводное отверстие диафрагмы у 3 пациентов (1,8%) и соскальзывание фундопликационной манжетки на кардиальный отдел желудка у 1 пациента (0,6%). Других, описанных в литературе вариантов рецидива, в частности изолированного расхождения ножек диафрагмы с формированием нового грыжевого мешка, нами не отмечено. Во всех случаях выполненных повторных оперативных вмешательств было выявлено укорочение пищевода.
Во время выполнения оперативного вмешательства при возникновении спонтанной десуфляции и падении давления в брюшной полости мы обратили внимание на то, что ножки диафрагмы, как и сама диафрагма, несколько меняют свое положение, смещаясь в строну желудка и занимая свое нормальное положение. Нами проведено исследование влияния десуфляции на длину пищевода (рис. 2). После окончания выделения грыжевого мешка и мобилизации пищевода в средостении мы производили измерение полученной длинны интраабдоминального сегмента пищевода, а затем выполняли десуфляцию и переводили пациента из положения Фоулера в более горизонтальное и повторяли измерение длинны пищевода повторно. С целью максимально точного определения длинны пищевода нами интраоперационно выполнялось эндоскопическое исследование, вовремя которого эндоскопист четко подсвечивал место кардиоэзофагеального перехода (Z-линию). В результате оказалось, что длинна интраабдоминальной части пищевода после десуфляции уменьшалась на 1,3 см (0,5–2 см).
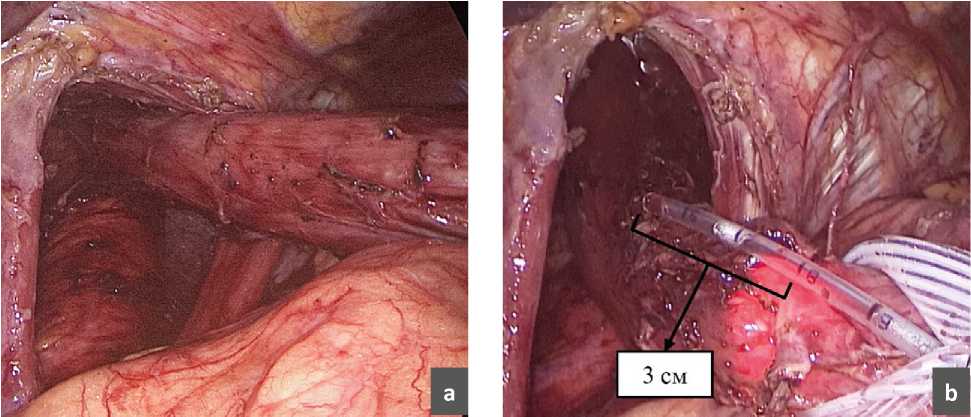
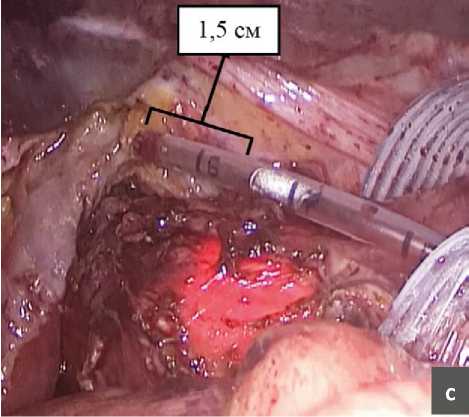
Рис. 2. Измерение длинны пищевода.
а – пищевод после высокой мобилизации в средостении;
b – измерение протяженности интраабдоминального сегментапищевода;
c – повторное измерение длинны пищевода после десуфляции.
Fig. 2. Measuring the length of the esophagus.
a – esophagus after high mobilization in the mediastinum;
b – measurement of the length of the intraabdominal segment ofthe esophagus;
c – repeated measurement of the length of the esophagus after
desuflation.
ОБСУЖДЕНИЕ
Одной из основных проблем после лапароскопических вмешательств, выполненных по поводу ГПОД, является высокая частота возникновения рецидива. По данным литературы, рецидив отмечается в среднем в 15–25% [2, 3, 5–7], а в отдельных источниках достигает 65% [8, 9].Несмотря на то, что большинство рецидивов протекает бессимптомно, достаточно трудно диагностировать минимальный рецидив у полностью бессимптомных пациентов,
по аналогии с первичными ГПОД [11] можно предположить, что с течением времени часть бессимптомно протекающих рецидивов рано или поздно станут симптомными и потребуют повторного оперативного вмешательства. Учитывая, что пластика ГПОД, тем более осложненных ГЭРБ, в подавляющем большинстве случаев преследует цель улучшения качества жизни пациента, она должна иметь минимальный процент осложнений и неудовлетворительных результатов, что в свою очередь постулирует необходимость улучшения отдаленных результатов лечения.
Анализ результатов лечения пациентов после лапароскопичекой пластики ГПОД показал неудовлетворительный результат лечения, отмеченный у 22,8% пациентов. Если говорить об эффективности применения сетчатых имплантов, на сегодняшний день^ несмотря на то, что достаточно большой процент хирургов рутинно использует данный метод хирургического пособия, исследования по эффективности различных способов фиксации и влияния материалов, используемых при создании сетчатого импланта продолжаются и являются актуальными, сегодня обращает на себя внимание появление достаточного количества публикаций, в частности рандомизированных исследований Watsonetal. [12] и Ooretal. [13], а также последнего мета-анализа Campos et al. [14], отметивших отсутствие преимущества аллопластики в сравнении с простым шовным способом крурорафии в отдаленном периоде. Проводя детальный анализ различных методик оперативного вмешательства, как показано выше, мы не отметили преимущества применения сетчатых имплантов либо способа используемой фундопликации. Вышесказанное послужило основанием обратить более пристальное внимание на проблему короткого пищевода у данной категории пациентов как возможно ведущей причины развития неудовлетворительного результата.
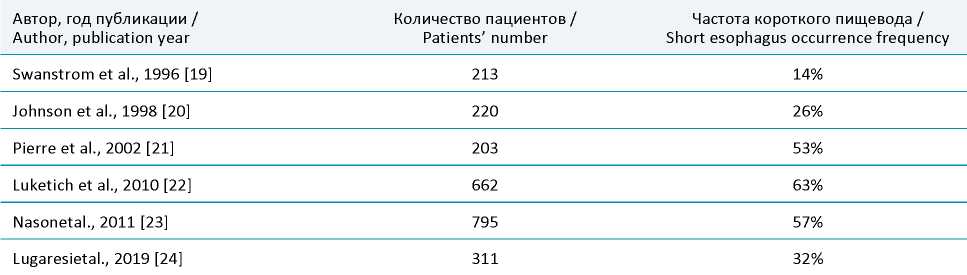
Проблема короткого пищевода известна достаточно давно. Впервые короткий пищевод рентгенологически описал Plenk в 1922 году, а как интраоперационную проблему во время выполнения пластик по поводу ГПОД – Harrington в 1931 году [15]. Несмотря на то, что часть авторов полностью исключают укорочение пищевода из причин возникновения ГПОД и ГЭРБ либо не отмечают укорочение пищевода во время выполнения оперативного вмешательства по поводу данной патологии [16], большая когорта хирургов считает одним из основных прогностических признаков, влияющих на развитие рецидива в отдаленном периоде, не размер или характер содержимого самой грыжи, а именно наличие короткого пищевода у данной категории пациентов [17][18]. Так, частота встречаемости истинного короткого пищевода при оперативных вмешательствах, выполненных по поводу ГПОД, сильно разнится и колеблется от 0 до 60%, в среднем составляя 15–25% (табл. 3).
Таблица 3. Частота встречаемости короткого пищевода при выполнении лапароскопических пластик ГПОД
Table 3. The frequency of a short esophagus occurrence when performing a laparoscopic HH plastic correction
Основным приемом, применяемым для увеличения длинны пищевода при его укорочении, является гастропластика по Коллису [17–24]. Некоторые авторы вообще ратуют практически за рутинное применение процедуры удлинения пищевода по Коллису при выполнении оперативных вмешательств по поводу ГПОД [21][22][23]. Тем не менее, по данным литературы данный прием в среднем используется не более чем в 3–5% [18], что на наш взгляд не совсем коррелирует с частотой встречаемости короткого пищевода.
По мере наблюдения за пациентами и появления опыта повторных оперативных вмешательств нами отмечено, что во всех случаях, потребовавших повторного оперативного вмешательства, интраоперационно диагностировано укорочение пищевода. Более того, при выявлении рецидива ГПОД любого характера, пересматривая и анализируя видео ранее выполненной операции, мы так же обратили внимание на то, что у части пациентов имелось укорочение пищевода, хотя длина интраабдоминальной части пищевода была не менее 2 см, либо в отдельных случаях была нами неправильно оценена.
Мы попытались ответить на вопрос, какая длина интраабдоминальной части пищевода после окончания его мобилизации должна быть достаточной перед формированием фундопликационной манжетки. Первой проблемой явилась сама методика определения длинны пищевода. Так, с одной стороны, невозможно определить истинную длину пищевода, не зная точную проекцию пищеводно-желудочного перехода, которую можно определить только посредством интраоперационной гастроскопии. С другой стороны, как показано ранее, а также отмечено некоторыми авторами, после десуфляции и перевода пациента в горизонтальное положение истинная длинна пищевода изменяется в меньшую сторону. По нашим данным укорочение пищевода после десуфляции составило 1,3 см.
Необходимость формирования фундопликационной манжетки как окончательного этапа оперативного вмешательства заключается, с одной стороны, в предотвращении рефлюкса вследствие увеличения давления в области нижнего пищеводного сфинктера, и с другой стороны, по мнению некоторых авторов, само формирование фундопликационной манжеты, в особенности при фиксации последней к стенке пищевода и ножкам диафрагмы, в создании дополнительного препятствия к герниации желудка в средостение [25]. Для выполнения своей функции фундопликационная манжетка должна располагаться строго на пищеводе. Какой должна быть длина фундопликационной манжетки? Как показал анализ собственных данных, у пациентов, не имевших клинических и рентгенологических признаков рецидива ГПОД или дисфагии, протяженность расправленной фундопликационной манжетки при рентгенконтрастном исследовании составила 3,2 см. Суммируя данный результат с полученной протяженностью укорочения пищевода на 1,3 см после десуфляции, мы можем сделать предположение, что необходимая длина интраабдоминальной части пищевода перед формированием фундопликационной манжетки должна составлять не менее 4–5 см, а не 2–3 см, как рекомендуется большинством авторов. Не устраненное интраоперационно укорочение пищевода может являться причиной миграции фундопликационной манжетки в средостение либо соскальзывание на кардиальный отдел желудка, с последующе ее деформацией и потерей функции в отдаленном периоде.
С целью изучения влияния укорочения пищевода на отдаленные результаты хирургического лечения пациентов с ГПОД, нами с 2013 года начато проспективное исследование. Суть исследования состояла в следующем (рис. 3). Все пациенты с данной патологией оперированы согласно стандартной общепринятой методике, которая включала выделение грыжевого мешка, высокую мобилизацию пищевода в средостении, крурорафию простым шовным способом и фундопликацию по Ниссену. Пациенты были разделены на 2 группы в зависимости от показаний к процедуре удлинения пищевода. Первую группу составили пациенты, которым процедура удлинения пищевода выполнялась только при протяженности интраабдоминальной части пищевода менее 2 см, причем процедура удлинения пищевода начиналась с передней ваготомии, в случае если протяженность пищевода оставалась менее 2 см, выполнялась гастропластика по Коллису. Вторую группу составили пациенты, которым процедура удлинения пищевода выполнялась при протяженности его интраабдоминальной части менее 4 см. В данной группе с целью удлинения пищевода применялась только гастропластика по Коллису. В 2019 году набор пациентов в исследование был окончен. В настоящий момент материал находится на этапе обработки и анализа.
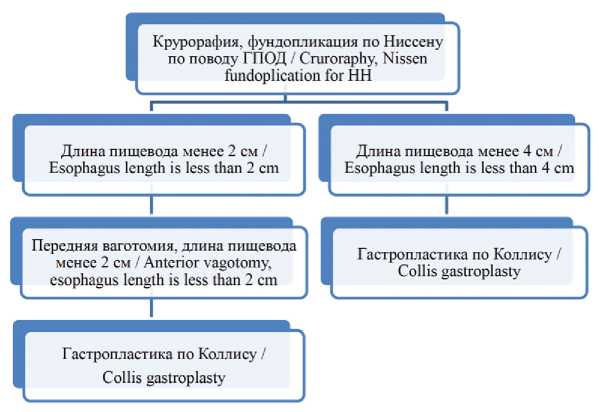
Рис. 3. Дизайн проспективного исследования по изучению влияния короткого пищевода на результаты лечения ГПОД.
Fig. 3. Design of a prospective study on the effect of a short esophagus on the results of HH treatment.
ЗАКЛЮЧЕНИЕ
Не смотря на высокую эффективность лапароскопических вмешательств по поводу ГПОД высокий процент неудовлетворительных результатов для операций, направленных на улучшение качества жизни, требует осмысленного анализа и поиска возможных причин развития рецидивов в отдаленном периоде. Одним из возможных факторов, влияющих на частоту развития рецидива, является не диагностированный и не редуцированный интраоперационно короткий пищевод, который в нашей когорте пациентов был диагностирован во всех случаях повторных оперативных вмешательств. Необходимо проведение более точных исследований и обобщение имеющихся данных, уточняющих истинную частоту встречаемости укорочения пищевода у данной группы пациентов и эффективность применения процедур по удлинению пищевода в контексте снижения частоты неудовлетворительного результата после лапароскопических пластик ГПОД.
Список литературы
1. Пучков К.В., Филимонов В.Б. Грыжи пищеводного отверстия диафрагмы. М.: Медпрактика-М, 2003, 172 с.
2. Andolfi C, Jalilvand A, Plana A, Fisichella PM. Surgical Treatment of Paraesophageal Hernias: A Review. J Laparoendosc Adv Surg Tech A. 2016 Oct;26(10):778–783. https://doi.org/10.1089/lap.2016.0332
3. Грубник В.В., Малиновский А.В. Критические аспекты лапароскопической хирургии гастроэзофагеальной рефлюксной болезни и грыж пищеводного отверстия диафрагмы. Одесса: ВМВ-типография, 2015.
4. Зябрева И.А., Джулай Т.Е. Грыжи пищеводного отверстия диафрагмы: спорные, нерешенные и перспективные аспекты проблемы (обзор литературы). Верхневолжский медицинский журнал. 2015;14(4):24–28.
5. Kohn GP, Price RR, DeMeester SR, Zehetner J, Muensterer OJ, Awad Z, et al. Guidelines for the management of hiatal hernia. Surg Endosc. 2013 Dec;27(12):4409–4428. https://doi.org/10.1007/s00464-013-3173-3
6. Tam V, Winger DG, Nason KS. A systematic review and meta-analysis of mesh vs suture cruroplasty in laparoscopic large hiatal hernia repair. Am J Surg. 2016 Jan;211(1):226–238. https://doi.org/10.1016/j.amjsurg.2015.07.007
7. Huddy JR, Markar SR, Ni MZ, Morino M, Targarona EM, Zaninotto G, et al. Laparoscopic repair of hiatus hernia: Does mesh type influence outcome? A meta-analysis and European survey study. Surg Endosc. 2016 Dec;30(12):5209–5221. https://doi.org/10.1007/s00464-016-4900-3
8. Oelschlager BK, Pellegrini CA, Hunter JG, Brunt ML, Soper NJ, Sheppard BC, et al. Biologic prosthesis to prevent recurrence after laparoscopic paraesophageal hernia repair: long-term follow-up from a multicenter, prospective, randomized trial. J Am Coll Surg. 2011 Oct;213(4):461–468. https://doi.org/10.1016/j.jamcollsurg.2011.05.017
9. Dallemagne B, Kohnen L, Perretta S, Weerts J, Markiewicz S, Jehaes C. Laparoscopic repair of paraesophageal hernia. Longterm follow-up reveals good clinical outcome despite high radiological recurrence rate. Ann Surg. 2011 Feb;253(2):291– 296. https://doi.org/10.1097/SLA.0b013e3181ff44c0
10. Li J, Cheng T. Mesh erosion after hiatal hernia repair: the tip of the iceberg? Hernia. 2019 Dec;23(6):1243–1252. https://doi.org/10.1007/s10029-019-02011-w
11. Stylopoulos N, Gazelle GS, Rattner DW. Paraesophageal hernias: operation or observation? Ann Surg. 2002 Oct;236(4):492–500; discussion 500–501. https://doi.org/10.1097/00000658-200210000-00012
12. Watson DI, Thompson SK, Devitt PG, Smith L, Woods SD, Aly A, et al. Laparoscopic repair of very large hiatus hernia with sutures versus absorbable mesh versus nonabsorbable mesh: a randomized controlled trial. Ann Surg. 2015 Feb;261(2):282–289. https://doi.org/10.1097/SLA.0000000000000842
13. Oor JE, Roks DJ, Koetje JH, Broeders JA, van Westreenen HL, Nieuwenhuijs VB, et al. Randomized clinical trial comparing laparoscopic hiatal hernia repair using sutures versus sutures reinforced with non-absorbable mesh. Surg Endosc. 2018 Nov;32(11):4579– 4589. https://doi.org/10.1007/s00464-018-6211-3
14. Campos V, Palacio DS, Glina F, Tustumi F, Bernardo WM, Sousa AV. Laparoscopic treatment of giant hiatal hernia with or without mesh reinforcement: A systematic review and meta-analysis. Int J Surg. 2020 May;77:97–104. https://doi.org/10.1016/j.ijsu.2020.02.036
15. Herbella FAM, Patti MG, Del Grande JC. When did the esophagus start shrinking? The history of the short esophagus. Dis Esophagus. 2009;22(7):550–558. https://doi.org/10.1111/j.1442-2050.2009.00956.x
16. Madan AK, Frantzides CT, Patsavas KL. The myth of the short esophagus. Surg Endosc. 2004 Jan;18(1):31–34. https://doi.org/10.1007/s00464-002-8611-6
17. Hartwig MG, Najmeh S. Technical Options and Approaches to Lengthen the Shortened Esophagus. Thorac Surg Clin. 2019 Nov;29(4):387–394. https://doi.org/10.1016/j.thorsurg.2019.07.004
18. Kunio NR, Dolan JP, Hunter JG. Short esophagus. Surg Clin North Am. 2015 Jun;95(3):641–652. https://doi.org/10.1016/j.suc.2015.02.015
19. Swanstrom LL, Marcus DR, Galloway GQ. Laparoscopic Collis gastroplasty is the treatment of choice for the shortened esophagus. Am J Surg. 1996 May;171(5):477–481. https://doi.org/10.1016/S0002-9610(96)00008-6
20. Johnson AB, Oddsdottir M, Hunter JG. Laparoscopic Collis gastroplasty and Nissen fundoplication. A new technique for the management of esophageal foreshortening. Surg Endosc. 1998 Aug;12(8):1055–1060. https://doi.org/10.1007/s004649900780
21. Pierre AF, Luketich JD, Fernando HC, Christie NA, Buenaventura PO, Litle VR, et al. Results of laparoscopic repair of giant paraesophageal hernias: 200 consecutive patients. Ann Thorac Surg. 2002 Dec;74(6):1909–1915; discussion 1915–1916. https://doi.org/10.1016/s0003-4975(02)04088-2
22. Luketich JD, Nason KS, Christie NA, Pennathur A, Jobe BA, Landreneau RJ, et al. Outcomes after a decade of laparoscopic giant paraesophageal hernia repair. J Thorac Cardiovasc Surg. 2010 Feb;139(2):395–404. https://doi.org/10.1016/j.jtcvs.2009.10.005
23. Nason KS, Luketich JD, Awais O, Abbas G, Pennathur A, Landreneau RJ, et al. Quality of life after collis gastroplasty for short esophagus in patients with paraesophageal hernia. Ann Thorac Surg. 2011 Nov;92(5):1854–1860; discussion 1860-1861. https://doi.org/10.1016/j.athoracsur.2011.06.030
24. Lugaresi M, Mattioli B, Daddi N, Bassi F, Pilotti V, Ferruzzi L, et al. True Short Esophagus in Gastro-esophageal Reflux Disease: Old Controversies With New Perspectives. Ann Surg. 2019 Sep 3. https://doi.org/10.1097/SLA.0000000000003582
25. Siegal SR, Dolan JP, Hunter JG. Modern diagnosis and treatment of hiatal hernias. Langenbecks Arch Surg. 2017 Dec;402(8):1145–1151. https://doi.org/10.1007/s00423-017-1606-5
Об авторах
А. Г. ГринцовУкраина
Гринцов Александр Григорьевич – д.м.н., профессор, заведующий кафедры хирургии стоматологического факультета
SPIN: 7136-8950, AuthorID: 303899
83003, г. Донецк, просп. Ильича, д. 16
Р. В. Ищенко
Россия
Ищенко Роман Викторович – д.м.н., заместитель главного врача по хирургии
SPIN: 9021-7370, AuthorID: 1045336
115682, г. Москва, Ореховый бульвар, д. 28
И. В. Совпель
Украина
Совпель Игорь Владимирович – к.м.н., доцент кафедры онкологии; заведующий операционным отделением
SPIN: 1769-2380, AuthorID: 1039795
83003, г. Донецк, просп. Ильича, д. 16
83092, г. Донецк, ул. Полоцкая, д. 2а
О. В. Совпель
Украина
Совпель Олег Владимирович – д.м.н., профессор кафедры онкологии; заведующий онкохирургическим отделением №6
Scopus AuthorID: 55761617800
83003, г. Донецк, просп. Ильича, д. 16
83092, г. Донецк, ул. Полоцкая, д. 2а
В. В. Балабан
Россия
Балабан Владимир Владимирович – к.м.н., врач-онколог, доцент кафедры хирургии Института клинической медицины
119991, г. Москва, ул. Трубецкая, д. 8, стр. 2
Рецензия
Для цитирования:
Гринцов А.Г., Ищенко Р.В., Совпель И.В., Совпель О.В., Балабан В.В. Причины неудовлетворительных результатов после лапароскопических пластик грыж пищеводного отверстия диафрагмы. Research'n Practical Medicine Journal. 2021;8(1):40-52. https://doi.org/10.17709/2409-2231-2021-8-1-4
For citation:
Grintcov A.G., Ishchenko R.V., Sovpel I.V., Sovpel O.V., Balaban V.V. Causes of unsatisfactory results after laparoscopic hiatal hernia repair. Research and Practical Medicine Journal. 2021;8(1):40-52. (In Russ.) https://doi.org/10.17709/2409-2231-2021-8-1-4


























